Достижения в области ранней диагностики болезни Альцгеймера радикально меняют подходы к лечению этого заболевания. Более 57 миллионов человек во всем мире страдают от деменции, и, по оценкам Всемирной организации здравоохранения (ВОЗ), к 2050 году это число увеличится до 139 миллионов.
На болезнь Альцгеймера приходится от 60% до 70% случаев заболевания во всем мире . В свете этих проблем новейшие научные открытия обещают радикально изменить методы и сроки диагностики заболевания, открывая путь к персонализированной и менее инвазивной медицине.
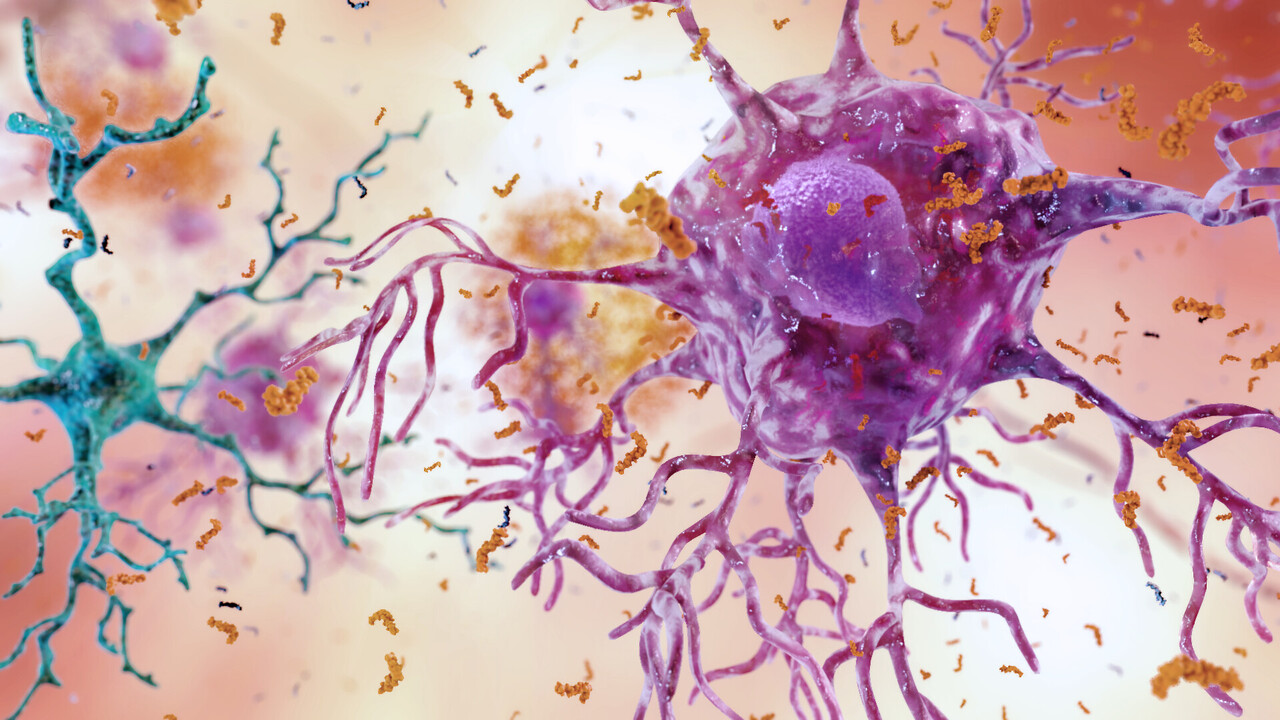
Возможность выявления ранних признаков болезни Альцгеймера с помощью анализа крови больше не является фантастической гипотезой. Комплексное исследование кардиолога Эрика Топола показывает, как биомаркеры крови, в частности плазменный белок p-tau217, становятся многообещающим инструментом для диагностики этого заболевания.
Работа, на которую обратил внимание Топол, была проведена под руководством Хенрика Зеттерберга из Гётеборгского университета и Барбары Бендлин из Университета Висконсина в Мэдисоне. Эти эксперты заявили: «Многочисленные исследования показывают, что наиболее перспективным биомаркером болезни Альцгеймера является плазменный p-tau217, который отражает аспекты, связанные с заболеванием, и предоставляет информацию о нейронном ответе, позволяющую прогнозировать нейродегенерацию».
Журнал «Биологические биомаркеры при болезни Альцгеймера и других нейродегенеративных деменциях» исследует потенциал плазменных биомаркеров для преобразования исследований и здравоохранения. Как отмечают эксперты в статье в журнале Nature, «биомаркеры на основе биологических жидкостей произвели революцию в исследованиях и лечении нейродегенеративных заболеваний, предоставив информацию о молекулярной основе болезни Альцгеймера и других нейродегенеративных деменций».
В тексте подчеркивается, что оптимизированные технологии позволяют обнаруживать молекулы, связанные с нейродегенеративными процессами, в минимальных концентрациях в крови, что расширяет возможности неинвазивной диагностики и облегчает раннее назначение лечения.
Фонд Паскуаля Марагаля заявляет: «Биомаркеры — это биологические индикаторы, используемые для измерения и анализа нормальных процессов в организме, патологических состояний или реакции на лечение. В случае болезни Альцгеймера биомаркеры играют важную роль, позволяя проводить раннюю диагностику, еще до появления первых симптомов, а также отслеживать прогрессирование заболевания и оценивать эффективность потенциальных методов лечения».
Дальнейшие исследования биомаркеров и болезни Альцгеймера
Datorită biomarkerilor, diagnosticul precoce al bolii Alzheimer suferă o potențială schimbare de paradigmă: medicii vor putea identifica semnele inițiale și determina progresia bolii fără a recurge, ca primă opțiune, la proceduri invazive, cum ar fi puncția lombară pentru obținerea lichidului cefalorahidian sau investigații neurovizualizante voluminoase. Acest lucru înseamnă că analizele de sânge apropie confirmarea diagnosticului de practica clinică de rutină.
Dezvoltarea de analize de sânge precise nu se limitează la p-tau217. Măsurarea combinată a pTau 217 și β-amiloid 1-42 în plasmă permite concluzionarea prezenței plăcilor în creier, care sunt considerate unul dintre semnele caracteristice ale bolii Alzheimer. Cu toate acestea, aceste noi metode trebuie încă să depășească dificultățile care apar din cauza factorilor biologici individuali care pot influența interpretarea rezultatelor, ceea ce reprezintă un aspect central al programului de cercetare actual.
Anterior, un studiu multicentric , la care au participat peste 2500 de pacienți din clinicile din Coreea de Sud, iar probele au fost analizate pe trei platforme internaționale de analiză cantitativă . Studiul a evaluat diferite strategii de optimizare a preciziei diagnosticului și de reducere a costurilor. Au fost comparate trei abordări: pragul standard, pragurile ajustate pentru diferite subgrupuri biologice și strategia pragului dublu, în care se adaugă o zonă intermediară de „incertitudine diagnostică”.
Rezultatele arată că ajustarea valorilor de referință p-tau217 în funcție de caracteristicile pacientului, cum ar fi insuficiența renală, anemia sau obezitatea, crește acuratețea diagnosticului și eficiența economică. De exemplu, la persoanele cu boală renală cronică, personalizarea pragului de diagnostic a crescut precizia de la 0,65 la 0,83 , reducând necesitatea unor investigații suplimentare. La pacienții cu anemie, ajustarea a crescut precizia de la 0,80 la 0,86 , deși utilizarea mai frecventă a investigațiilor suplimentare a compensat parțial aceste avantaje.
Pentru persoanele cu obezitate, abordarea în două etape cu „zonă gri” a demonstrat avantaje semnificative atât în ceea ce privește precizia, cât și eficiența economică. Cu toate acestea, această strategie a dus la obținerea de rezultate intermediare în 12-39% din cazuri în diferite subgrupuri, ceea ce a crescut necesitatea de teste de confirmare, cu excepția cazurilor de obezitate, unde avantajele au fost menținute.
Aceste rezultate confirmă importanța diagnosticării personalizate. Ajustarea parametrilor biomarkerilor în conformitate cu profilul biologic optimizează fiabilitatea analizelor de sânge și reduce costurile asistenței medicale. Potrivit autorilor studiului , medicina personalizată în diagnosticul precoce al bolii Alzheimer crește valoarea prognostică a testelor, mai ales având în vedere diversitatea biologică a populației.
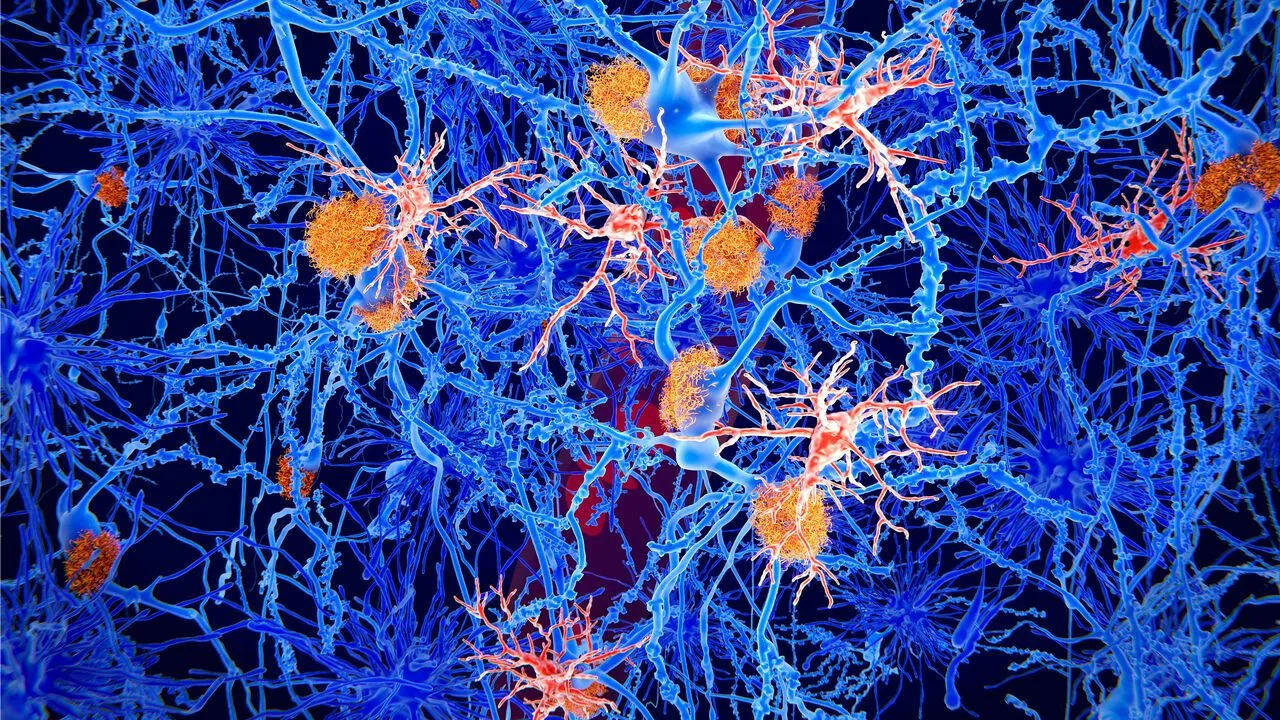
Interesul pentru biomarkerii din lichidele biologice depășește cadrul diagnosticării precoce. Realizări semnificative, precum dezvoltarea anticorpilor monoclonali împotriva beta-amiloidului, demonstrează modul în care identificarea precisă a modificărilor moleculare relevante deschide calea nu numai pentru diagnosticare, ci și pentru noi strategii moleculare de prevenire și tratament . Utilizarea biomarkerilor ajută la selectarea pacienților pentru studiile clinice și la monitorizarea răspunsului la metodele experimentale de tratament.
Timp de mulți ani, diagnosticul bolii Alzheimer s-a bazat strict pe criterii clinice și pe manifestarea simptomelor cognitive. Cu toate acestea, integrarea biomarkerilor a evidențiat existența unei faze preclinice: leziunile cerebrale încep cu mult înainte de apariția simptomelor, în așa-numita „fază asimptomatică”.
Conform informațiilor prezentate în revistă, posibilitatea de a detecta aceste modificări ale creierului prin analiza biomarkerilor din sânge sau lichidul cefalorahidian este motorul strategiilor preventive. Obiectivul este de a încetini sau amâna progresia demenței la persoanele care nu prezintă încă semne clinice, dar care au deja anomalii detectabile ale creierului.
Utilitatea biomarkerilor se extinde și la alte domenii. Pe lângă moleculele și proteinele prezente în sânge, modificările pot fi vizualizate cu ajutorul unor metode de imagistică, cum ar fi tomografia cu emisie de pozitroni (PET), care permite evaluarea plăcilor amiloide sau activarea celulelor gliale. Un studiu publicat în revista Nature nu numai că analizează biomarkerii deja utilizați, dar oferă și recomandări practice privind interpretarea acestora în practica clinică de zi cu zi.
Dezvoltarea de metode de analiză capabile să distingă formele specifice ale proteinei tau reprezintă o altă direcție de cercetare menită să depășească limitările existente și să îmbunătățească diagnosticul precoce al bolii Alzheimer. O astfel de diferențiere va permite o mai bună compensare a influenței variabilității biologice individuale, care reprezintă o problemă serioasă în extrapolarea studiilor populaționale în practica clinică.
Biomarkerele nu numai că permit identificarea bolii, dar ajută și la evaluarea progresului degenerării creierului și a eficacității potențialelor metode de tratament. Conform datelor Fundației Pascual Maragal, pentru aplicarea lor clinică sunt necesare numeroase studii de cohortă la scară largă, care vor confirma în timp fiabilitatea lor în identificarea bolilor.
Până de curând, se credea că boala Alzheimer începe odată cu apariția simptomelor. Acum, odată cu extinderea utilizării biomarkerilor, situația se schimbă: primele semne pot fi detectate cu zeci de ani înainte de apariția primelor simptome . Această informație este crucială pentru prevenire, deoarece permite intervenția în stadiul incipient și poate schimba evoluția bolii.
Cu toate acestea, există nuanțe cheie: nu toate persoanele la care se observă modificări ale unuia sau mai multor biomarkeri vor dezvolta neapărat simptome clinice ale bolii Alzheimer. Acest lucru subliniază necesitatea interpretării rezultatelor în combinație cu evaluarea clinică și alte investigații suplimentare, pentru a evita hiperdiagnosticarea sau tratamentul inutil.
În conformitate cu cele mai semnificative descoperiri revoluționare, studiul realizat de Thomas R. Gilarte și echipa sa de la Colegiul de Sănătate Publică și Asistență Socială Robert Stempel de la Universitatea Internațională din Florida (FIU) a arătat că TSPO , proteina translocatoare cu masa de 18 kDa, poate fi un biomarker inițial al neuroinflamației asociate cu boala Alzheimer. Această descoperire, obținută în urma studiilor pe modele animale și eșantioane umane cu mutații genetice precoce, subliniază faptul că neuroinflamația este un eveniment foarte primitiv în evoluția naturală a bolii.
TSPO este prezent în creier în concentrații scăzute, dar nivelul său crește semnificativ atunci când echilibrul din creier este perturbat, așa cum se întâmplă în cazul neuroinflamației asociate cu boala Alzheimer. Acesta poate fi vizualizat cu ajutorul scanării PET, unde zonele afectate capătă o nuanță roșu-portocalie pronunțată, ceea ce permite identificarea inflamației creierului înainte de apariția tulburărilor cognitive.
În modelul utilizat pe animale, șoareci transgenici 5XFAD , această creștere a nivelului de TSPO a coincis cu apariția primelor plăci amiloide în zona importantă pentru memorie, subculumul. Această creștere a putut fi detectată la șoareci deja la vârsta de 1,5 luni , cu multe luni înainte de apariția oricăror simptome comportamentale. La femele, problemele cognitive au apărut la vârsta de șapte luni, iar la masculi — la vârsta de douăsprezece luni.
O analiză detaliată a arătat că nivelul crescut de TSPO a fost determinat în principal de extinderea populației de celule microgliale activate, în special a celor care se află în contact direct cu plăcile amiloide. Deși astrocitele au prezentat unele semne de activare, nu s-a observat o creștere semnificativă a nivelului de TSPO, după cum explică autorii.
Verificabilitatea acestor rezultate a fost confirmată după observarea probelor post mortem de țesut cerebral uman, în special în cazurile cu mutația PSEN1-E280A , că natura creșterii nivelului de TSPO a fost, de asemenea, asociată cu microgliile care intră în contact cu plăcile. Potrivit lui Thomas R. Gilarte, „neuroinflamarea este un eveniment foarte timpuriu în boala Alzheimer, care influențează debutul acesteia”. Dacă TSPO poate fi utilizat pentru depistarea bolii Alzheimer în stadiul incipient, acest lucru ar putea „încetini progresia sau amâna apariția simptomelor cu cinci-șase ani”, ceea ce ar îmbunătăți semnificativ calitatea vieții pacienților.
Несмотря на важность этого открытия, исследовательская группа указывает на некоторые ограничения: исследование было основано на моделях животных и небольшом наборе образцов тканей человека, все из которых соответствовали ранним генетическим формам заболевания и были получены от мужчин. Это подчеркивает необходимость расширения исследования на другие популяции и более широкий спектр типов болезни Альцгеймера, включая формы с поздним началом. Мартинес-Перес, член группы, уже начала новый этап анализа тканей головного мозга человека из случаев болезни с поздним началом, чтобы подтвердить и расширить эти результаты.
Клиническая валидация биомаркеров требует строгих и длительных процессов. Только после подтверждения их диагностической надежности их можно в полной мере внедрить в рутинную практику. Хотя их использование все еще находится на стадии обширных исследований, биомаркеры предоставляют важные подсказки для профилактики и лечения болезни Альцгеймера.
Эти биологические маркеры могут принимать различные формы: молекулы, белки или анатомические изменения, выявляемые с помощью методов визуализации. Они лежат в основе тихой революции в понимании и лечении болезни Альцгеймера, помогая выявлять, отслеживать прогресс и объективно оценивать экспериментальные и одобренные методы лечения, чтобы смягчить воздействие болезни на миллионы людей и учреждения, которые оказывают им помощь.





